软骨细胞培养指南
20世纪60年代起人们对软骨组织的研究进入到细胞水平。
1967 年 ManningWK 等使用胰蛋白酶联合细菌胶原酶消化分离与培养人软骨细胞获得成功。
目前人软骨细胞体外分离与培养的方法已被广泛应用于软骨细胞生物学研究,为骸骨软化症、骨关节炎( osteoarthritis , OA )等疾病的防治及组织工程技术修复软骨缺损等研究提供了重要的方法学参考。
人软骨细胞特点
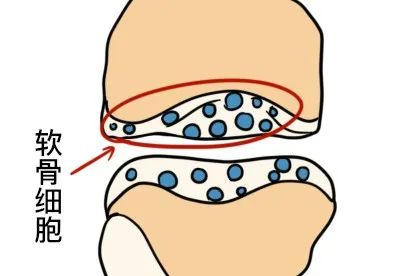
幼稚的软骨细胞位于软骨组织的表层,单个分布,体积较小,呈椭圆形,长轴与软骨表面平行,越向深层的软骨细胞体积之间增大呈圆形,细胞核圆形或卵圆形,染色浅,细胞质弱嗜碱性,常见数量不一的脂滴。
成熟的软骨细胞多2~8个成群分布于软骨陷窝内,这些软骨细胞由同一个母细胞分裂增殖而成,称为同源细胞群。电镜下,软骨细胞有突起和皱褶,细胞质内有大量的粗面内质网和发达的高尔基复合体及少量的线粒体。在组织切片中,软骨细胞收缩为不规则形,在软骨囊和细胞之间出现较大的腔隙。
软骨细胞培养及传代
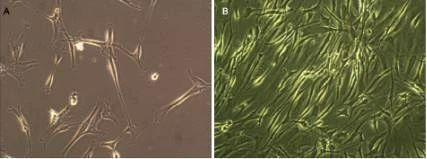
图A为原代细胞分离培养软骨细胞贴壁后的形态,细胞呈多角型,扁平状,胞质丰富,可见清晰、圆形的细胞核,部分区软骨细胞集落样生长。
图B为软骨细胞传代培养后的形态,细胞似椭圆形,细胞胞浆丰富。
随传代次数不断增加,软骨细胞集落中的梭形细胞数目逐渐增多。
为什么一传代就变形?
在体外培养人软骨细胞时,随着传代次数增加软骨标志性蛋白Ⅱ胶原合成分泌减少,而Ⅰ、Ⅲ型胶原合成分泌增多。
Ⅱ胶原的合成和分泌是维持软骨细胞分化表型的特征性指标,提供了软骨特有的张力和硬度。
软骨中的其他分子与胶原蛋白结合形成网状结构,支持软骨具有一定的弹性,对于软骨维持形状及承载外来负荷起着非常重要的作用。
所以,随着传代次数的增加,维持细胞形态的物质会逐渐减少,细胞的形态就会发生改变。
这种形态和功能的变化称之为反分化现象,也是单层传代细胞的普遍现象。
软骨细胞传代方法

1. 低密度培养的软骨细胞易发生去分化现象,一般最适接种密度为2~10×10^4/cm2;
2. 软骨细胞代谢较为缓慢,无需增加换液频度,可能破坏由细胞分泌而形成的群体化学环境。
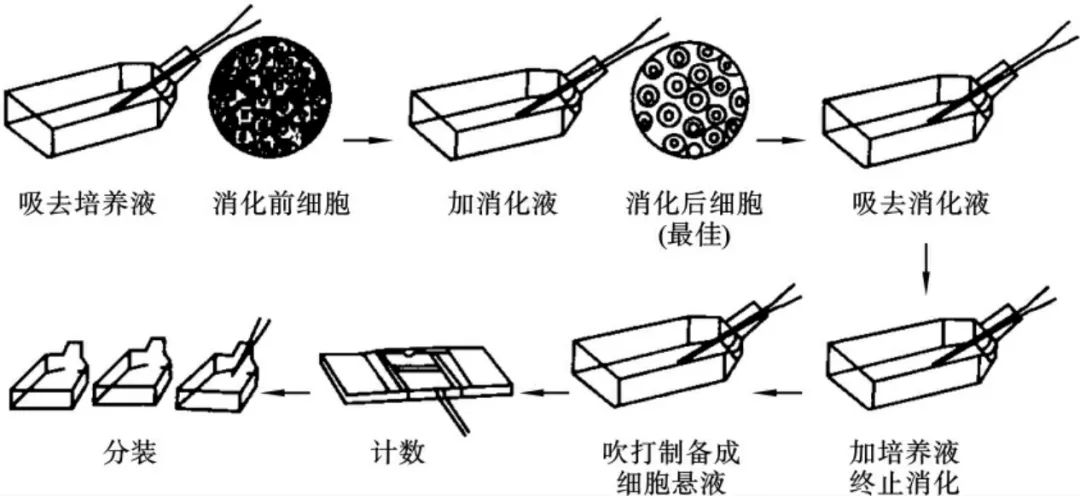
传代步骤
如果细胞密度达80%-90%,即可进行传代培养。
1. 弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2. 加2ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
3. 按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养液后吹匀。
4. 将细胞悬液按1:2到1:5的比例分到新的含8ml培养基的新皿中或者瓶中。